手臂输液港与胸壁输液港“安全大PK”
完全植入式静脉输液港 (totally implantable venous access ports, TIVAP) 是一种可植入皮下长期留置在体内的静脉输液装置, 主要由供穿刺的注射座和静脉导管系。根据穿刺部位的不同分为经锁骨下静脉或颈静脉穿刺植入,称胸部输液港和通过上臂静脉植入手臂输液港。国外1990年首次报告手臂输液港,而国内自2014年才相继出现相关报告上臂植入式输液港,是近几年国内才开展的最新静脉输液技术,是静脉输液港的升级版,手臂输液港多以手臂贵要静脉、肱静脉、头静脉等作为入路植入导管,港座完全埋入手臂皮下,避免了放在胸部而引起的气胸、血胸、误穿动脉、导管夹闭综合征等并发症。 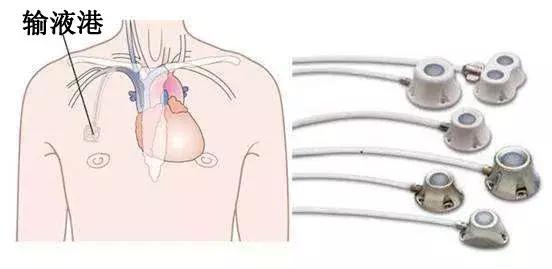 但手臂输液港安全性与胸壁输液港相比较有无差异?徐海萍等通过Meta分析对两种植港技术中感染、血栓、堵管、败血症、港座皮肤裂开等常见并发症的差异进行量化评价。 两种输液港血栓发生率比较结果显示手臂输液港组血栓发生率低于胸壁输液港组,合并效应有统计学意义;两种输液港感染发生率、堵管发生率、败血症发生率、皮肤裂开发生均无统计学意义。 研究结果显示, 手臂输液港组血栓发生率低于胸壁输液港。多项研究发现,患者发生恶性肿瘤及骨髓增生障碍以及接受手术和化疗、激素治疗、感染、生物学异常和导管尖端位置不合适等是血栓发生的重要因素,而港座位置非主要影响因素。手臂输液港导管路径虽然较胸壁输液港长,但是如果静脉管腔和导管比例合适并不会增加血栓形成;手臂输液港血栓发生率低,还有可能是因为手臂活动较胸壁频繁且幅度大,使得导管在血管内移动较多,不利于血液附着形成血栓。 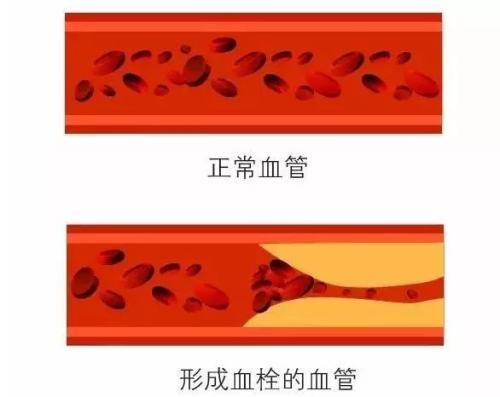 研究结果显示, 手臂输液港组与胸壁输液港组感染发生率差异无统计学意义。感染因素包括:导管出口部位感染,通过沿外导管传播病原体,导管中心的污染导致病原体腔内定植和血行传播,或因为化疗相关的医源性中性粒细胞减少导致。Shiono等认为感染是术后并发症,导管使用方法和并发症发生率之间的关系尚不清楚,但正确的导管路径角度可能有助于防止感染;另一种可能是,有氧/厌氧菌密度和皮肤温度会影响感染的发生。手臂输液港与胸壁输液港的港座及导管完全植入体内,体外无任何装置,可减少皮肤定植的微生物迁移至皮下并定植于导管尖端引起的感染风险。 研究结果显示, 手臂输液港组与胸壁输液港组堵管率、败血症、皮肤裂开等差异均无统计学意义。输液港及时正确冲管及封管,减少输液港导管及港座内药物或血液残存,保证通畅,能有效预防堵管。输液港感染一般容易发生在置管后3~4d,10~14d出现败血症的概率最高;导管败血症的典型临床表现是寒战、高热,体温平均高达39 ℃,伴有白细胞和中性粒细胞升高;沿导管皮下遂道附近偶有红斑、硬结、触痛或化脓。输液港手术及维护操作中严格遵守无菌原则有利于降低感染及败血症发生。输液港的囊袋切口放置在一个放松的或解剖上中立的位置,准确地缝合伤口边缘,在最小张力下缝合,确保伤口没有血肿或感染,是防止瘢痕裂开的基本条件。  总结 手臂输液港与胸壁输液港植入后感染发生率、堵管率、败血症和皮肤裂开发生率差异均无统计学意义,而在血栓发生率方面手臂输液港更低,并且手臂输液港导管入路在外周血管,能避免穿刺置管引发的血胸、气胸和夹闭综合征的风险;港座小使得囊袋的切口小,隧道短,疼痛减轻;港座的囊袋切口选择在手臂内侧,更加隐蔽美观,输液插针时仅需患者上卷衣袖,更好地保护患者隐私;手臂输液港胸部无港座产生的异物摩擦感,方便患者使用汽车安全带以及女性患者佩戴胸罩;手臂输液港植入时皮下隧道短,输液、输血障碍明显低于胸壁输液港;对于乳腺癌放疗、胸部摄片、颈部以及上胸部同侧胸大肌皮瓣肿瘤复发、放射性皮炎或伴有呼吸功能损害的患者,手臂输液港是较好的选择。另外胸壁输液港植入主要由外科医生或麻醉医师在手术室或导管室按外科手术要求完成,时间存在不确定性,手臂输液港由静脉治疗专科护士在专用的深静脉置管B超引导下操作,取得医生配合埋入注射座,确保事件确定性和可控性,加强医护合作,体现静脉治疗专科护士的专业价值。 但由于上臂植入式输液港在国内开展时间较短,许多问题有待我们进一步实施探索。
|






